PROCESO
ISOTÉRMICO
Se denomina proceso
isotérmico o proceso isotermo al cambio reversible en un sistema termodinámico, siendo dicho cambio
a temperatura constante
en todo el sistema. La compresión o expansión de un gas ideal puede
llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a
la misma temperatura que el gas. Este otro sistema se conoce como foco calórico.
De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas
se expanda realizando trabajo. Como la energía interna de un gas ideal sólo
depende de la temperatura y ésta permanece constante en la expansión isoterma,
el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.

La energía interna depende de la temperatura. Por lo tanto, si
un gas ideal es sometido a un proceso isotérmico, la variación de energía
interna es igual a cero.
Por lo tanto, la expresión de la 1ª Ley de la Termodinámica
Por lo tanto, la expresión de la 1ª Ley de la Termodinámica
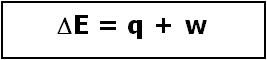
se convierte en q = - w
PROCESO
ISOBÁRICO
Un proceso isobárico es un proceso termodinámico que ocurre a
presión constante. La Primera Ley de la Termodinámica, para este caso, queda
expresada como sigue:

Donde:
 = calor transferido
= calor transferido = energía interna
= energía interna = presión
= presión = volumen
= volumen
En un diagrama P-V, un proceso isobárico aparece como una
línea horizontal.muy larga y corta y que W=3.000*6-16 =17.894

No hay comentarios:
Publicar un comentario